Objectifs d’apprentissage
- Écrire la formule chimique d’un composé ionique simple.
- Reconnaître les ions polyatomiques dans les formules chimiques.
Nous avons déjà rencontré quelques formules chimiques de composés ioniques simples. Une formule chimique est une liste concise des éléments d’un composé et des ratios de ces éléments. Pour mieux comprendre ce que signifie une formule chimique, nous devons examiner comment un composé ionique est construit à partir de ses ions.
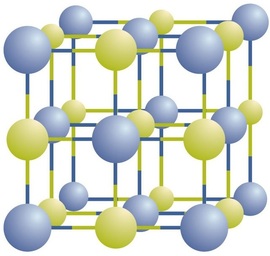
Les composés ioniques existent sous forme d’ions positifs et négatifs alternés dans des réseaux tridimensionnels réguliers appelés cristaux (figure \(\PageIndex{1}\)). Comme vous pouvez le voir, il n’y a pas de « particules » individuelles dans le réseau ; il s’agit plutôt d’un réseau continu d’ions sodium et chlorure alternant. Cependant, nous pouvons utiliser le rapport entre les ions sodium et les ions chlorure, exprimé par les nombres entiers les plus bas possibles, pour décrire le composé. Dans le cas du chlorure de sodium, le rapport entre les ions sodium et les ions chlorure, exprimé en nombres entiers les plus faibles, est de 1:1. Nous utilisons donc \(\ce{NaCl}\) (un symbole \(\ce{Na}\) et un symbole \(\ce{Cl}\)) pour représenter le composé. Ainsi, \(\ce{NaCl}\) est la formule chimique du chlorure de sodium, qui est un moyen concis de décrire le nombre relatif des différents ions dans le composé. Un échantillon macroscopique est composé de myriades de paires NaCl, chaque paire individuelle étant appelée unité de formule. Bien qu’il soit pratique de penser que les cristaux de NaCl sont composés d’unités individuelles de NaCl, la figure \(\PageIndex{1}\) montre qu’aucun ion n’est exclusivement associé à un autre ion. Chaque ion est entouré d’ions de charge opposée.
La formule d’un composé ionique suit plusieurs conventions. Tout d’abord, le cation est écrit avant l’anion. Comme la plupart des métaux forment des cations et que la plupart des non-métaux forment des anions, les formules énumèrent généralement le métal en premier, puis le non-métal. Deuxièmement, les charges ne sont pas écrites dans une formule. Rappelez-vous que dans un composé ionique, les espèces constitutives sont des ions et non des atomes neutres, même si la formule ne contient pas de charges. Enfin, la formule correcte d’un composé ionique présente toujours une charge nette nulle, ce qui signifie que la charge positive totale doit être égale à la charge négative totale. Pour déterminer la formule propre de n’importe quelle combinaison d’ions, il faut déterminer combien de chaque ion est nécessaire pour équilibrer les charges positives et négatives totales du composé.
Cette règle est finalement basée sur le fait que la matière est, globalement, électriquement neutre.
Par convention, on suppose qu’il n’y a qu’un seul atome si un indice n’est pas présent. On n’utilise pas 1 comme indice.
Si l’on regarde le composé ionique constitué d’ions lithium et d’ions bromure, on constate que l’ion lithium a une charge 1+ et l’ion bromure une charge 1-. Un seul ion de chaque est nécessaire pour équilibrer ces charges. La formule du bromure de lithium est \(\ce{LiBr}\).
Lorsqu’un composé ionique est formé à partir de magnésium et d’oxygène, l’ion magnésium a une charge 2+, et l’atome d’oxygène a une charge 2-. Bien que ces deux ions aient des charges plus élevées que les ions du bromure de lithium, ils s’équilibrent toujours dans un rapport de un à un. Par conséquent, la formule appropriée pour ce composé ionique est \(\ce{MgO}\).
Envisageons maintenant le composé ionique formé par le magnésium et le chlore. Un ion de magnésium a une charge 2+, tandis qu’un ion de chlore a une charge 1- :
La combinaison d’un ion de chaque ne permet pas d’équilibrer complètement les charges positives et négatives. La façon la plus simple d’équilibrer ces charges est de supposer la présence de deux ions chlorure pour chaque ion magnésium :
Maintenant les charges positives et négatives sont équilibrées. Nous pourrions écrire la formule chimique de ce composé ionique sous la forme \(\ce{MgClCl}\), mais la convention est d’utiliser un indice numérique lorsqu’il y a plus d’un ion d’un type donné-\(\ce{MgCl2}\). Cette formule chimique indique qu’il y a un ion magnésium et deux ions chlorure dans cette formule. (Ne lisez pas la partie « Cl2 » de la formule comme une molécule de chlore élémentaire diatomique. Le chlore n’existe pas en tant qu’élément diatomique dans ce composé. Il existe plutôt sous forme de deux ions chlorure individuels). Par convention, le rapport du nombre entier le plus faible est utilisé dans les formules des composés ioniques. La formule \(\ce{Mg2Cl4}\) a des charges équilibrées avec les ions dans un rapport de 1:2, mais ce n’est pas le rapport de nombre entier le plus bas.
Par convention, le rapport de nombre entier le plus bas des ions est utilisé dans les formules des composés ioniques. Il existe des exceptions pour certains ions, comme \(\ce{Hg2^{2+}}\).
Pour les composés dans lesquels le rapport des ions n’est pas aussi évident, les indices de la formule peuvent être obtenus en croisant les charges : utiliser la valeur absolue de la charge d’un ion comme indice de l’autre ion. Cette méthode est représentée schématiquement sur la figure 3.3.2.
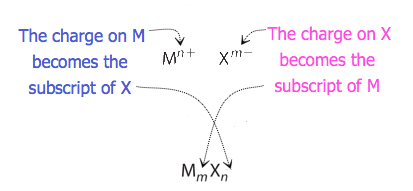
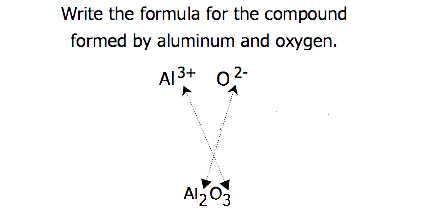
Lorsque l’on croise les charges, il est parfois nécessaire de réduire les indices à leur plus simple rapport pour écrire la formule empirique. Considérons, par exemple, le composé formé par Pb4+ et O2-. En utilisant les valeurs absolues des charges sur les ions comme indices, on obtient la formule Pb2O4. Celle-ci se simplifie en sa formule empirique correcte PbO2. La formule empirique comporte un ion Pb4+ et deux ions O2-.
Exemple \(\PageIndex{1}\)
Écrivez la formule chimique d’un composé ionique composé de chaque paire d’ions.
- l’ion sodium et l’ion soufre
- l’ion aluminium et l’ion fluorure
- l’ion fer 3+ et l’ion oxygène
Solution
- Pour obtenir un octet de coquille de valence, le sodium forme un ion avec une charge 1+, tandis que l’ion soufre a une charge 2-. Deux ions 1+ de sodium sont nécessaires pour équilibrer la charge 2- de l’ion soufre. Plutôt que d’écrire la formule comme \(\ce{NaNaS}\), nous l’abrégeons par convention en \(\ce{Na2S}\).
- L’ion aluminium a une charge 3+, tandis que l’ion fluorure formé par le fluor a une charge 1-. Trois ions fluor 1- sont nécessaires pour équilibrer la charge 3+ de l’ion aluminium. Cette combinaison s’écrit comme \(\ce{AlF3}\).
- Le fer peut former deux ions possibles, mais l’ion avec une charge 3+ est spécifié ici. L’atome d’oxygène a une charge 2 en tant qu’ion. Pour équilibrer les charges positives et négatives, on se tourne vers le multiple le moins commun-6 : deux ions 3+ de fer donneront 6+, tandis que trois ions 2- d’oxygène donneront 6-, équilibrant ainsi les charges positives et négatives globales. La formule de ce composé ionique est donc : \(\ce{Fe2O3}\). Vous pouvez également utiliser la méthode des charges croisées présentée à la figure 3.3.2.
Exercice \(\PageIndex{1}\)
Écrivez la formule chimique d’un composé ionique composé de chaque paire d’ions.
- l’ion calcium et l’ion oxygène
- l’ion cuivre 2+ et l’ion soufre
- l’ion cuivre 1+ et l’ion soufre
Réponse a :
CaO
Réponse b :
CuS
Réponse c :
Cu2S
Ions polyatomiques
Certains ions sont constitués de groupes d’atomes liés entre eux de façon covalente et ont une charge électrique globale. Comme ces ions contiennent plus d’un atome, ils sont appelés ions polyatomiques. Les structures de Lewis, les noms et les formules de certains ions polyatomiques se trouvent dans le tableau 3.3.1.
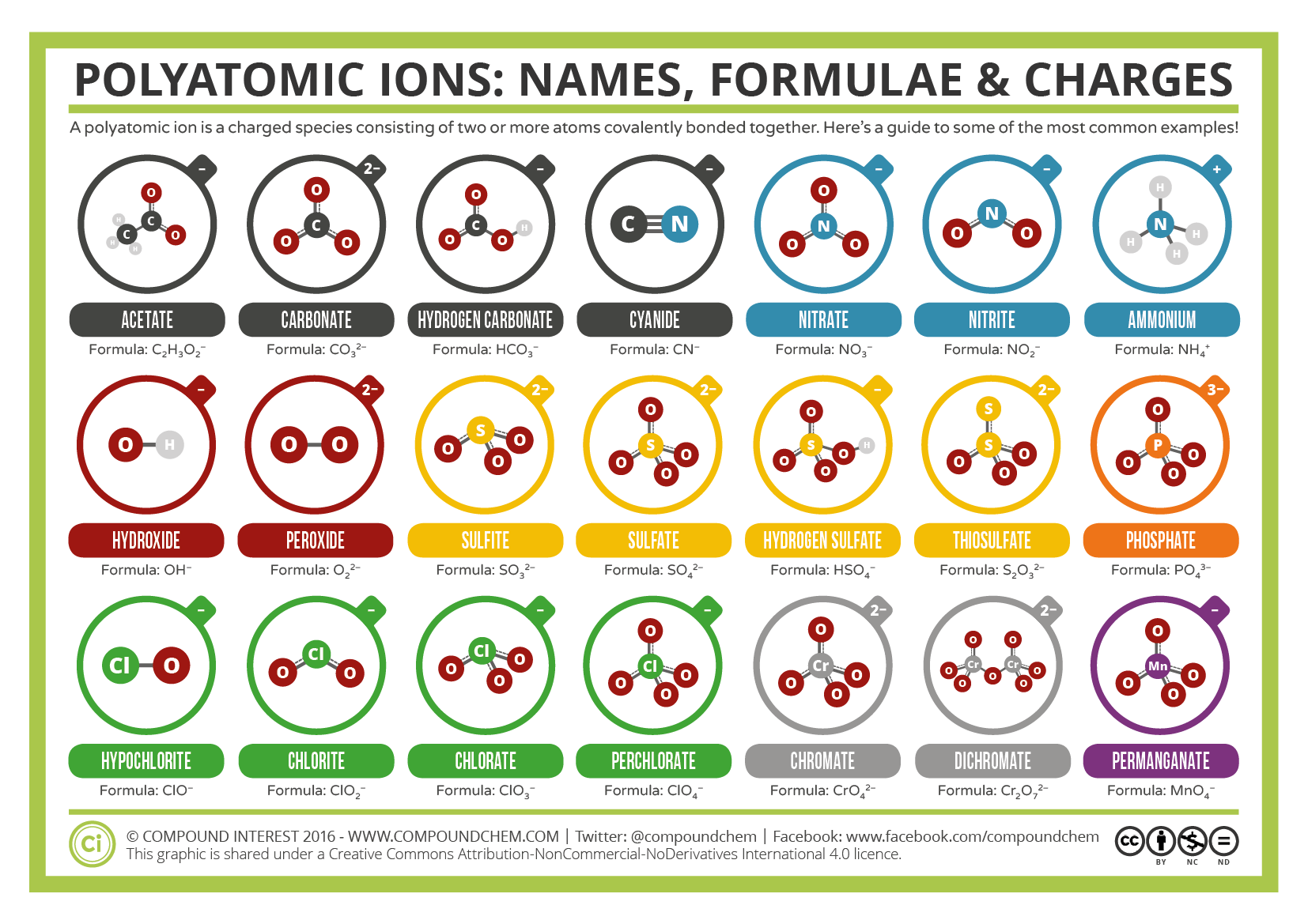
Tableau \(\PageIndex{1}\) : Quelques ions polyatomiques
Les ions polyatomiques ont des formules, des noms et des charges définis qui ne peuvent être modifiés en aucune façon. Le tableau \(\PageIndex{2}\) répertorie les noms et les formules des ions polyatomiques les plus courants. Par exemple, \(\ce{NO3^{-}}\) est l’ion nitrate ; il possède un atome d’azote et trois atomes d’oxygène et une charge globale de 1. La figure \(\PageIndex{2}\) énumère les ions polyatomiques les plus courants.
| Nom de l’ion | Formule de l’ion |
|---|---|
| Ion ammonium | NH4+1 |
| ion hydroxyde | OH-1 |
| ion cyanure | CN-1 | ion carbonate | CO3-2 |
| bicarbonate ou hydrogénocarbonate | HCO3- |
| acétate | C2H3O2-1 ou CH3CO2-1 |
| ion nitrate | NO3-1 |
| ion nitrite | NO2-1 |
| ion sulfate | SO4-2 |
| ion sulfite | SO3-2 |
| ion phosphate | PO4-3 |
| ion phosphite | PO3-3 |
Notez qu’un seul ion polyatomique dans ce tableau, l’ion ammonium (NH4+1), est un cation. Cet ion polyatomique contient un azote et quatre hydrogènes qui portent collectivement une charge +1. Les autres ions polyatomiques sont tous chargés négativement et sont donc classés parmi les anions. Cependant, seuls deux d’entre eux, l’ion hydroxyde et l’ion cyanure, sont nommés à l’aide du suffixe « -ide » qui indique généralement les particules chargées négativement. Les autres anions polyatomiques, qui contiennent tous de l’oxygène, en combinaison avec un autre non-métal, font partie d’une série dans laquelle le nombre d’oxygènes dans l’unité polyatomique peut varier. Comme cela a été souligné à plusieurs reprises dans plusieurs sections de ce texte, deux formules chimiques ne doivent pas partager un nom chimique commun. Un seul suffixe, « -ide », est insuffisant pour distinguer les noms des anions dans une série polyatomique apparentée. Par conséquent, les suffixes « -ate » et « -ite » sont employés pour indiquer que les ions polyatomiques correspondants font partie d’une série. De plus, ces suffixes indiquent également le nombre relatif d’oxygènes contenus dans les ions polyatomiques. Notez que tous les ions polyatomiques dont le nom se termine par « -ate » contiennent un oxygène de plus que les anions polyatomiques dont le nom se termine par « -ite ». Malheureusement, tout comme le système courant de dénomination des métaux de transition, ces suffixes n’indiquent que le nombre relatif d’oxygènes contenus dans les ions polyatomiques. Par exemple, l’ion nitrate, qui est symbolisé par NO3-1, possède un oxygène de plus que l’ion nitrite, qui est symbolisé par NO2-1. En revanche, l’ion sulfate est symbolisé par SO4-2. Bien que l’ion nitrate et l’ion sulfate partagent tous deux le suffixe « -ate », le premier contient trois oxygènes, alors que le second en contient quatre. De plus, l’ion nitrate et l’ion sulfite contiennent tous deux trois oxygènes, mais ces ions polyatomiques ne partagent pas de suffixe commun. Malheureusement, la nature relative de ces suffixes impose que les combinaisons formule d’ion/nom d’ion des ions polyatomiques soient simplement mémorisées.
La règle pour construire les formules des composés ioniques contenant des ions polyatomiques est la même que pour les formules contenant des ions monatomiques (à un seul atome) : les charges positives et négatives doivent s’équilibrer. Si plusieurs ions polyatomiques sont nécessaires pour équilibrer la charge, la formule entière de l’ion polyatomique doit être mise entre parenthèses, et l’indice numérique est placé à l’extérieur des parenthèses. Cela permet de montrer que l’indice s’applique à l’ensemble de l’ion polyatomique. Deux exemples sont présentés ci-dessous :

Exemple \(\PageIndex{2}\)
Écrivez la formule chimique d’un composé ionique composé de chaque paire d’ions.
- l’ion potassium et l’ion sulfate
- l’ion calcium et l’ion nitrate
Solution
- Les ions potassium ont une charge de 1+, tandis que les ions sulfate ont une charge de 2-. Nous aurons besoin de deux ions potassium pour équilibrer la charge de l’ion sulfate, donc la formule chimique appropriée est \(\ce{K_2SO_4}\).
- Les ions calcium ont une charge de 2+, tandis que les ions nitrate ont une charge de 1-. Nous aurons besoin de deux ions nitrate pour équilibrer la charge de chaque ion calcium. La formule du nitrate doit être mise entre parenthèses. Ainsi, nous écrivons \(\ce{Ca(NO3)2}\) comme formule pour ce composé ionique.
Exercice \(\PageIndex{2}\)
Écrivez la formule chimique d’un composé ionique composé de chaque paire d’ions.
- l’ion magnésium et l’ion carbonate
- l’ion aluminium et l’ion acétate
Réponse a :
Mg2+ et CO32- = MgCO3
Réponse b :
Al3+ et C2H3O2- = Al(C2H3O2)3
Reconnaître les composés ioniques
Il existe deux façons de reconnaître les composés ioniques. Premièrement, les composés entre des éléments métalliques et non métalliques sont généralement ioniques. Par exemple, CaBr2 contient un élément métallique (le calcium, un métal du groupe 2A) et un élément non métallique (le brome, un non-métal du groupe 7A). Il s’agit donc très probablement d’un composé ionique. (En fait, il est ionique.) En revanche, le composé NO2 contient deux éléments qui sont tous deux non métalliques (azote, du groupe 5A, et oxygène, du groupe 6A). Ce n’est pas un composé ionique ; il appartient à la catégorie des composés covalents dont il est question ailleurs. Notez également que cette combinaison d’azote et d’oxygène n’a pas de charge électrique spécifiée, ce n’est donc pas l’ion nitrite.
Deuxièmement, si vous reconnaissez la formule d’un ion polyatomique dans un composé, le composé est ionique. Par exemple, si vous voyez la formule \(\ce{Ba(NO3)2}\), vous pouvez reconnaître la partie « NO3 » comme l’ion nitrate, \(\rm{NO_3^-}\). (Rappelez-vous que la convention pour écrire les formules des composés ioniques est de ne pas inclure la charge ionique). Ceci est un indice que l’autre partie de la formule, \(\ce{Ba}\), est en fait l’ion \(\ce{Ba^{2+}}\), la charge 2+ équilibrant la charge globale 2- des deux ions nitrate. Ainsi, ce composé est également ionique.
Exemple \(\PageIndex{3}\)
Identifiez chaque composé comme ionique ou non ionique.
- (\ce{Na2O})
- (\ce{PCl3})
- (\ce{NH4Cl})
- (\ce{OF2})
Solution
- Le sodium est un métal, et l’oxygène est un non-métal ; Par conséquent, on s’attend à ce que le \(\ce{Na2O}\) soit ionique.
- Le phosphore et le chlore sont tous deux des non-métaux. Par conséquent, \(\ce{PCl3}\) n’est pas ionique.
- Le \(\ce{NH4}\) dans la formule représente l’ion ammonium, \(\ce{NH4^{+}\), ce qui indique que ce composé est ionique.
- L’oxygène et le fluor sont tous deux non métalliques. Par conséquent, \(\ce{OF2}\) n’est pas ionique.
Exercice \(\PageIndex{3}\)
Identifiez chaque composé comme ionique ou non ionique.
- (\ce{N2O})
- (\ce{FeCl3})
- (\ce{(NH4)3PO4})
- (\ce{SOCl2})
Réponse a :
non ionique
Réponse b :
ionique
Réponse c :
ionique
Réponse d :
non ionique
En regardant de plus près : Sang et eau de mer
La science a reconnu depuis longtemps que le sang et l’eau de mer ont des compositions similaires. Après tout, ces deux liquides contiennent des composés ioniques dissous. Cette similitude pourrait être plus qu’une simple coïncidence ; de nombreux scientifiques pensent que les premières formes de vie sur Terre sont apparues dans les océans. Un examen plus approfondi montre toutefois que le sang et l’eau de mer sont très différents. Une solution de chlorure de sodium à 0,9 % correspond approximativement à la concentration de sel présente dans le sang. En revanche, l’eau de mer est principalement une solution de chlorure de sodium à 3 %, soit plus de trois fois la concentration dans le sang. Voici une comparaison des quantités d’ions dans le sang et l’eau de mer :
| Ion | Pourcentage dans l’eau de mer | Pourcentage dans le sang | Na+ | 2.36 | 0,322 |
|---|---|---|
| Cl- | 1,94 | 0.366 | Mg2+ | 0,13 | 0.002 |
| SO42- | 0.09 | – |
| K+ | 0,04 | 0.016 | Ca2+ | 0,04 | 0.0096 |
| HCO3- | 0.002 | 0,165 | HPO42-, H2PO4- | – | 0.01 |
La plupart des ions sont plus abondants dans l’eau de mer que dans le sang, à quelques exceptions importantes près. Il y a beaucoup plus d’ions hydrogénocarbonate (\(\ce{HCO3^{-}}\)) dans le sang que dans l’eau de mer. Cette différence est importante car l’ion carbonate d’hydrogène et certains ions apparentés jouent un rôle crucial dans le contrôle des propriétés acido-basiques du sang. La quantité d’ions hydrogénophosphate – \(\ce{HPO4^{2-}}\) et \(\ce{H2PO4^{-}}\) – dans l’eau de mer est très faible, mais ils sont présents en plus grande quantité dans le sang, où ils affectent également les propriétés acido-basiques. Une autre différence notable est que le sang ne contient pas de quantités significatives de l’ion sulfate (\ce{SO4^{2-}}\), mais cet ion est présent dans l’eau de mer.
Key Takeaways
- Les formules chimiques appropriées pour les composés ioniques équilibrent la charge positive totale avec la charge négative totale.
- Il existe également des groupes d’atomes ayant une charge globale, appelés ions polyatomiques.
EXERCICES
-
Quelles informations sont contenues dans la formule d’un composé ionique ?
Pourquoi les formules chimiques de certains composés ioniques contiennent-elles des indices, alors que d’autres n’en contiennent pas ?
3. Écrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- Mg2+ et I-
- Na+ et O2-
4. Écrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- Na+ et Br-
- Mg2+ et Br-
- Mg2+ et S2-
5. Écrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- K+ et Cl-
- Mg2+ et Cl-
- Mg2+ et Se2-
6. Ecrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- Na+ et N3-
- Mg2+ et N3-
- Al3+ et S2-
7. Ecrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- Li+ et N3-
- Mg2+ et P3-
- Li+ et P3-
8. Ecrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- Fe3+ et Br-
- Fe2+ et Br-
- Au3+ et S2-
- Au+ et S2-
9. Ecrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- Cr3+ et O2-
- Cr2+ et O2-
- Pb2+ et Cl-
- Pb4+ et Cl-
10. Ecrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- Cr3+ et NO3-
- Fe2+ et PO43-
- Ca2+ et CrO42-
- Al3+ et OH-
11. Écrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- NH4+ et NO3-
- H+ et Cr2O72-
- Cu+ et CO32-
- Na+ et HCO3-
12. Pour chaque paire d’éléments, déterminez la charge de leurs ions et écrivez la formule adéquate pour le composé ionique résultant entre eux.
- Ba et S
- Cs et I
13. Pour chaque paire d’éléments, déterminez la charge de leurs ions et écrivez la formule adéquate pour le composé ionique résultant entre eux.
- K et S
- Sc et Br
14. Quels composés seraient ioniques selon vous ?
- Li2O
- (NH4)2O
- CO2
- FeSO3
- C6H6
- C2H6O
15. Quels sont les composés dont vous prédirez qu’ils sont ioniques ?
- Ba(OH)2
- CH2O
- NH2CONH2
- (NH4)2CrO4
- C8H18
- NH3
Réponses
1. Le rapport de chaque type d’ion dans le composé
2. Parfois, plus d’un ion est nécessaire pour équilibrer la charge de l’autre ion dans un composé ionique.
- MgI2
- Na2O
- .
- NaBr
- MgBr2
- MgS
- KCl
- MgCl2
- MgSe
- Na3N
- Mg3N2
- Al2S3
- Li3N
- Mg3P2
- Li3P
.
- FeBr3
- FeBr2
- Au2S3
- Au2S
- Cr2O3
- CrO
- PbCl2
- PbCl4
- Cr(NO3)3
- Fe3(PO4)2
- CaCrO4
- Al(OH)3
- .
- NH4NO3
- H2Cr2O7
- Cu2CO3
- NaHCO3
- Ba2+, S2-, BaS
- Cs+, I-, CsI
- K+, S2-, K2S
- Sc3+, Br-, ScBr3
- ionique
- ionique
- non ionique
- ionique
- non ionique
- non ionique
.
- ionique
- non ionique
- non ionique
- ionique
- non ionique
- non ionique
.
0 commentaire