es sources les plus courantes d’hydrure nucléophile sont l’hydrure de lithium et d’aluminium (LiAlH4) et le borohydrure de sodium (NaBH4). Note ! L’anion hydrure n’est pas présent pendant cette réaction ; ces réactifs servent plutôt de source d’hydrure en raison de la présence d’une liaison métal-hydrogène polaire. L’aluminium étant moins électronégatif que le bore, la liaison Al-H dans LiAlH4 est plus polaire, ce qui fait de LiAlH4 un agent réducteur plus puissant.
Addition d’un anion hydrure (H 🙂 à un aldéhyde ou une cétone donne un anion alcoxyde qui, par protonation, donne l’alcool correspondant. Les aldéhydes produisent des 1º-alcools et les cétones des 2º-alcools.
Dans les réductions des hydrures métalliques, les sels d’alcoxydes obtenus sont insolubles et doivent être hydrolysés (avec précaution) avant de pouvoir isoler le produit alcool. Dans la réduction du borohydrure de sodium, le système de solvant méthanol réalise cette hydrolyse automatiquement. Dans la réduction de l’hydrure de lithium et d’aluminium, l’eau est généralement ajoutée dans une deuxième étape. Le lithium, le sodium, le bore et l’aluminium se retrouvent sous forme de sels inorganiques solubles à la fin des deux réactions. Remarque ! LiAlH4 et NaBH4 sont tous deux capables de réduire les aldéhydes et les cétones en l’alcool correspondant.
.
Mécanisme
Ce mécanisme concerne une réduction de LiAlH4. Le mécanisme pour une réduction de NaBH4 est le même, sauf que le méthanol est la source de protons utilisée dans la deuxième étape.
1) Attaque nucléopilique par l’anion hydrure
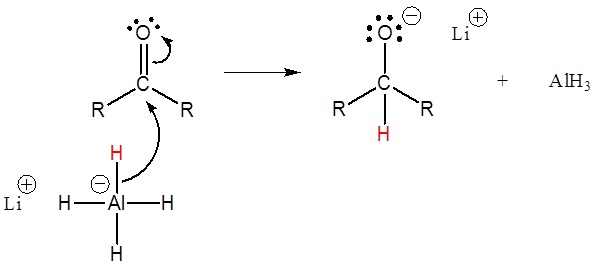
2) L’alcoolate est protoné
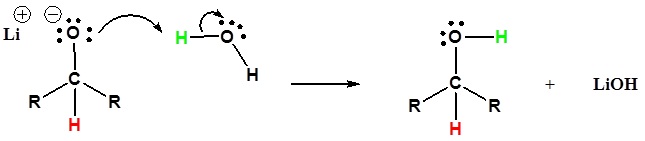
Passer des réactifs aux produits de manière simplifiée
Propriétés des sources d’hydrure
Deux sources pratiques de réactivité de type hydrure sont les métaux complexes.sont les hydrures métalliques complexes que sont l’hydrure de lithium et d’aluminium (LiAlH4) et le borohydrure de sodium (NaBH4). Ce sont tous deux des solides blancs (ou presque blancs), qui sont préparés à partir d’hydrures de lithium ou de sodium par réaction avec des halogénures et des esters d’aluminium ou de bore. L’hydrure de lithium et d’aluminium est de loin le plus réactif des deux composés, réagissant violemment avec l’eau, les alcools et autres groupes acides avec dégagement d’hydrogène gazeux. Le tableau suivant résume certaines caractéristiques importantes de ces réactifs utiles.
Il serait formidable de convertir ce tableau en texte.
Problèmes
1) Veuillez dessiner les produits des réactions suivantes :
2) Veuillez dessiner la structure de la molécule qui doit réagir pour donner le produit.
3) L’oxyde de deutérium (D2O) est une forme d’eau où les hydrogènes ont été remplacés par des deutériums. Pour la réduction de LiAlH4 suivante, l’eau habituellement utilisée a été remplacée par de l’oxyde de deutérium. Veuillez dessiner le produit de la réaction et placer le deutérium à l’endroit approprié. Astuce ! Regardez le mécanisme de la réaction.
Réponses
1)
.
3)
Contributeurs
- Prof. Steven Farmer (Sonoma State University)
- William Reusch, professeur émérite (Michigan State U.), Manuel virtuel de chimie organique
.
0 commentaire