Une cellule électrolytique typique peut être fabriquée comme le montre la figure \(\PageIndex{1}\). Deux conducteurs électriques (électrodes) sont immergés dans le liquide à électrolyser. Ces électrodes sont souvent constituées d’un matériau inerte tel que l’acier inoxydable, le platine ou le graphite. Le liquide à électrolyser doit être capable de conduire l’électricité, il s’agit donc généralement d’une solution aqueuse d’un électrolyte ou d’un composé ionique fondu. Les électrodes sont reliées par des fils à une batterie ou à une autre source de courant continu. Cette source de courant peut être considérée comme une « pompe à électrons » qui aspire les électrons d’une électrode et les expulse vers l’autre électrode. L’électrode dont les électrons sont retirés devient chargée positivement, tandis que l’électrode à laquelle ils sont fournis a un excès d’électrons et une charge négative.
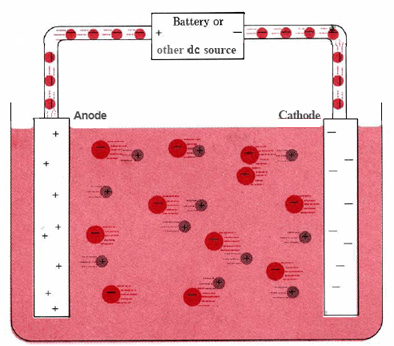
L’électrode chargée négativement attirera vers elle les ions positifs (cations) de la solution. Elle peut donner certains de ses électrons excédentaires à ces cations ou à d’autres espèces du liquide à électrolyser. Cette électrode est donc en fait un agent réducteur. Dans toute cellule électrochimique (électrolytique ou galvanique), l’électrode à laquelle se produit la réduction est appelée cathode.
L’électrode positive, en revanche, attirera vers elle les ions négatifs (anions). Cette électrode peut accepter des électrons de ces ions négatifs ou d’autres espèces dans la solution et se comporte donc comme un agent oxydant. Dans toute cellule électrochimique, l’anode est l’électrode à laquelle l’oxydation se produit. Un moyen facile de se rappeler quelle électrode est laquelle est que l’anode et l’oxydation commencent par des voyelles tandis que la cathode et la réduction commencent par des consonnes.
La vidéo suivante montre ce processus se déroulant dans une solution neutre d’eau avec quelques électrolytes présents.
A titre d’exemple de la façon dont l’électrolyse peut provoquer une réaction chimique, supposons que nous fassions passer un courant électrique continu à travers 1 M HCl. Les ions H3O+ de cette solution seront attirés vers la cathode, et les ions Cl- migreront vers l’anode. À la cathode, H3O+ sera réduit en gaz H2 selon la demi-équation
(Comme vu dans d’autres sections, nous écrirons H+ au lieu de H3O+ dans les demi-équations pour gagner du temps). À l’anode, les électrons seront acceptés des ions Cl-, les oxydant en Cl2 :
Pendant l’électrolyse, H2(g) et Cl2(g) bouillonnent respectivement à la cathode et à l’anode. L’équation globale de l’électrolyse est la somme des équations suivantes . \(\ref{1}\) et \(\ref{2}\) :
ou
La réaction nette est l’inverse de la combinaison spontanée de H2(g) avec Cl2(g) pour former HCl(aq). Un tel résultat est vrai pour l’électrolyse en général : le courant électrique fourni depuis l’extérieur du système provoque une réaction chimique non spontanée.
Bien que l’électrolyse inverse toujours une réaction d’oxydoréduction spontanée, le résultat d’une électrolyse donnée n’est pas toujours la réaction que nous souhaitons. Dans une solution aqueuse, par exemple, il y a toujours un grand nombre de molécules d’eau à proximité de l’anode et de la cathode. Ces molécules d’eau peuvent donner des électrons à l’anode ou accepter des électrons de la cathode, tout comme les anions ou les cations. Par conséquent, l’électrolyse peut oxyder et/ou réduire l’eau au lieu de faire réagir l’électrolyte dissous. Un exemple de ce problème est l’électrolyse du fluorure de lithium, LiF. Nous pourrions nous attendre à une réduction de Li+ à la cathode et à une oxydation de F- à l’anode, selon les demi-équations
Cependant, Li+ est un très mauvais accepteur d’électrons, et il est donc très difficile de forcer l’équation \(\ref{5}\) à se produire. Par conséquent, les électrons excédentaires de la cathode sont acceptés par les molécules d’eau à la place :
Une situation similaire se produit à l’anode. Les ions F- sont des agents réducteurs extrêmement faibles – beaucoup plus faibles que les molécules de H2O – et la demi-équation est donc
L’équation globale peut être obtenue en multipliant l’équation \(\ref{7}\) par 2, en l’ajoutant à l’équation \(\ref{8}\) et en combinant H+ avec OH- pour former H2O :
La vidéo suivante montre l’électrolyse de l’eau qui a lieu, en utilisant l’acide sulfurique comme pont pour permettre le transfert de charge. Une fois l’électrolyse terminée, on vérifie l’identité des gaz formés à l’aide de tests de bûchettes enflammées.
Cette électrolyse inverse donc la combinaison spontanée de H2 et O2 pour former H2O. En discutant des réactions d’oxydoréduction, nous mentionnons plusieurs agents oxydants, tels que qui sont assez forts pour oxyder H2O. En même temps, nous décrivons les agents réducteurs qui sont assez forts pour réduire H2O, comme les métaux alcalins et les alcalino-terreux plus lourds. En règle générale, ces substances ne peuvent pas être produites par électrolyse de solutions aqueuses, car H2O est oxydé ou réduit à la place. Les substances qui subissent une réaction d’oxydoréduction spontanée avec H2O sont généralement produites par électrolyse de sels fondus ou dans un autre solvant. Il existe cependant quelques exceptions à cette règle, car certaines réactions d’électrolyse sont plus lentes que d’autres. En utilisant le tableau 11.5, par exemple, nous pourrions prédire que H2O est un meilleur agent réducteur que Cl-.
Donc, nous nous attendrions à ce que O2, et non Cl2, soit produit par l’électrolyse de HCl 1 M, en contradiction avec l’équation \(\ref{1}\). Il s’avère que l’O2 est produit plus lentement que le Cl2, et que ce dernier sort de la solution sous forme de bulles avant que le H2O puisse être oxydé. Pour cette raison, le tableau 1 trouvé dans la section Couples Redox ne peut pas toujours être utilisé pour prédire ce qui se passera dans une électrolyse.
Contributeurs
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (Université du Minnesota Rochester), Tim Wendorff et Adam Hahn.
0 commentaire