Les patients atteints d’une maladie nécessitant la coopération de médecins de différentes spécialités sont confrontés à des risques dus à une mauvaise communication, à des objectifs perçus différents et à des bases de connaissances variables entre les sous-spécialités. Un exemple concerne la prescription d’hydroxychloroquine par les internistes pour les maladies auto-immunes et le dépistage des doses toxiques et de la rétinopathie par les ophtalmologistes. Dans cet aperçu, je vais identifier les lacunes dans la compréhension et la communication entre les spécialités qui conduisent à des cas évitables de rétinopathie, et discuter de la façon dont vous pouvez les combler.
Un problème persistant
Pourquoi les cas de rétinopathie à l’hydroxychloroquine continuent-ils à se développer, alors que sa pathogénie est connue depuis les années 1980 ? Parmi plusieurs causes contributives, la principale est que trop de patients se voient prescrire des doses quotidiennes toxiques.1 L’hydroxychloroquine est stockée dans les tissus maigres, et est largement exclue des graisses.2 Par conséquent, la posologie de l’HC doit être basée sur la masse corporelle maigre.3 Chez la plupart des gens, celle-ci peut être déterminée à partir de tableaux de poids corporel idéal (PCI) basés sur la taille. Cependant, chez les patients minces et asthéniques chez qui le poids corporel réel est inférieur au poids idéal, la posologie doit être basée sur le poids corporel réel (PTR) et non sur le PBI4. Bien qu’il existe quelques cas, il est extrêmement rare de développer une HR si la dose quotidienne ne dépasse pas 6,5 mg/kg en se basant sur l’utilisation du moindre du PCA et du PBI pour le dénominateur.5
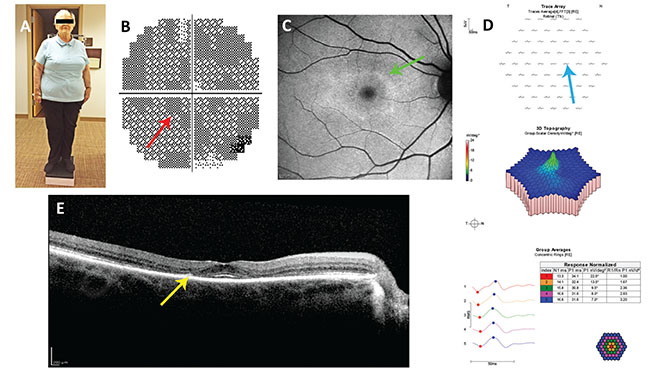
Figure 1. Rapport de cas n° 1. A : Notez le somatotype. Chez le patient obèse de petite taille, la posologie basée sur le poids corporel idéal, et non sur le poids corporel réel, est appropriée. B : Scotomata paracentral (flèche rouge) dans son test de champ visuel 10-2 de 2012, manqué par son ophtalmologiste. C : Anneau d’hyperautofluorescence (flèche verte) sur une image d’autofluorescence du fond d’œil bleu de 2014. D : Réduction des amplitudes des ondelettes paracentrales (flèche bleue) sur l’électrorétinographie multifocale. E : Perte paracentrale de la ligne ellipsoïde et amincissement de la couche nucléaire externe (flèche jaune) sur la tomographie par cohérence optique à domaine spectral.
Les publications ophtalmiques sont en partie responsables de la confusion qui règne quant à l’importance d’une dose quotidienne pour prévenir l’HR. Considérez ce que disent trois séries consécutives de directives de l’Académie américaine d’ophtalmologie (tableau 1) : Les lignes directrices de 2002 affirment que la dose quotidienne est d’une » importance primordiale » et conseillent l’utilisation de l’ABW, sauf chez les patients obèses, auquel cas l’IBW est recommandé. En 2011, les lignes directrices ont fait volte-face, minimisant l’importance de la dose quotidienne, sauf si le patient est obèse, auquel cas l’administration d’une DIB est conseillée. En 2016, les lignes directrices ont fait un flop, réaffirmant l’importance de la dose quotidienne, mais écartant le dosage par IBW tout en insistant sur le dosage par ABW et en introduisant un facteur de conversion différent.
Avec une telle incohérence, il est facile de comprendre comment les rhumatologues et les ophtalmologistes pourraient être confus quant à l’importance de la dose quotidienne et la façon dont elle devrait être calculée. Les directives de 2002 étaient potentiellement dangereuses en raison de leur manque de spécificité quant à la manière d’utiliser le poids brut ou le poids moyen pondéré dans le calcul de la dose quotidienne. Les directives de 2011 étaient potentiellement dangereuses pour la personne dont le PCA est inférieur au PBI (voir cas 1). Les directives de 2016 sont dangereuses pour la personne obèse chez qui le PBI est inférieur au PCA (voir cas 2).
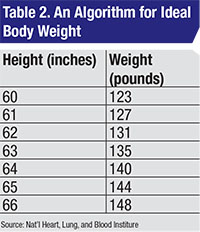
La prescription sûre de l’hydroxychloroquine n’est pas difficile. La dose quotidienne ne doit pas dépasser 6,5 mg/kg/j sur la base de la plus petite valeur entre le poids corporel moyen et le poids corporel moyen. Le choix de l’algorithme à utiliser pour la PBI est controversé, mais d’un point de vue pratique, il n’a probablement pas d’importance. Je préfère l’algorithme du National Heart, Lung, and Blood Institute (Tableau 2).3
Dans les sections suivantes, je décrirai des rapports de cas impliquant l’HC et j’expliquerai les problèmes de dosage impliqués.
Rapport de cas #1
Une femme de 74 ans atteinte de polyarthrite rhumatoïde a été mise sous hydroxychloroquine 400 mg/j en 2004. Elle mesurait 5 pieds, pesait 198 livres et ne souffrait d’aucune insuffisance rénale ou hépatique (figure 1). Elle a été adressée pour la première fois par son rhumatologue pour un dépistage de la rétinopathie en 2012, et avait perdu l’œil gauche suite à un traumatisme dans son enfance.
L’ophtalmologiste qui l’a dépistée en 2012 a constaté qu’elle avait une acuité visuelle corrigée de 20/20 à l’œil droit et a interprété son champ visuel 10-2 et son électrorétinogramme multifocal comme normaux, alors qu’ils ne l’étaient pas. Il n’a pas reconnu son dosage toxique et n’a fait aucune recommandation pour le modifier. Il lui a demandé de revenir dans six mois mais ne l’a jamais fait.
Un autre ophtalmologiste l’a examinée en 2014. Son acuité visuelle corrigée était de 20/20 à l’œil droit et son examen du fond d’œil était normal. Une FV 10-2 utilisant un objet test rouge a montré une progression d’un scotome annulaire qui était présent en 2012. Une étude d’imagerie par tomographie par cohérence optique à domaine spectral de la macula a montré une perte de la zone ellipsoïde parafovéale et un amincissement de la couche nucléaire externe.
Ce cas illustre les pièges suivants, évitables et fréquemment observés, dans la prise en charge multidisciplinaire du patient prenant de l’HC :
– Le rhumatologue a prescrit une dose toxique d’HC en fonction de la taille et du poids du patient. Le patient mesurait 5 pieds, avait un poids idéal de 123 livres (55,9 kg, voir tableau 2) et une dose maximale quotidienne sûre de 55,9 x 6,5=363 mg/j d’HC. Pour atteindre ce résultat en utilisant la taille de pilule disponible de 200 mg, il faut tenir compte du fait que l’HC a une longue demi-vie (environ 40 jours1). Ainsi, on peut omettre un jour de dosage dans une semaine et arriver à une dose quotidienne moyenne appropriée. Sur une semaine, cette patiente peut prendre jusqu’à 7 x 363=2 543 mg d’HC en toute sécurité. Si elle prend deux comprimés par jour du lundi au samedi et qu’elle ne prend pas d’HC le dimanche, sa dose totale hebdomadaire sera de 2 400 mg, ce qui donne une moyenne de 2 400/7=343 mg/j, ce qui est inférieur à une dose toxique.
– La patiente n’a pas eu d’examen de dépistage ophtalmique de base et n’a été envoyée en dépistage par un ophtalmologiste que huit ans après le début du traitement. Cela s’est produit en dépit du fait que la patiente présentait un risque élevé de toxicité en raison de sa dose quotidienne. Les directives de l’AAO stipulent qu’un examen de base doit être effectué, puis, pour les patients à faible risque, des examens annuels doivent commencer cinq ans plus tard. Les ophtalmologistes ont régulièrement rejeté ces recommandations.4,7 Plutôt que de continuer à recommander une lacune dans le dépistage qui est rejetée par ceux qui sont chargés de dépister la rétinopathie, il vaudrait mieux que les directives embrassent la réalité pratique que le dépistage annuel est la norme, ce qui, dans les premières années, vise principalement à détecter et à corriger le dosage quotidien toxique.
– Le médecin n’a pas reconnu et corrigé le dosage toxique de l’HC. Le dosage toxique est systématiquement trouvé chez 12,8 à 74,7 % des patients prenant de l’HC.4,8-10 La correction du dosage quotidien toxique est l’action la plus courante prise par l’ophtalmologiste de dépistage, et c’est la principale raison de dépister les patients prenant de l’HC. Lorsque le dosage est sûr, comme en Grande-Bretagne, le dépistage n’est pas recommandé car la rareté de l’HR dans ces circonstances en fait un gaspillage de ressources rares.11
– Le premier ophtalmologiste n’a pas reconnu les signes de toxicité sur la FV initiale 10-2. Le diagnostic de HR est basé sur des tests auxiliaires : FV 10-2, SD-OCT, mfERG et imagerie par autofluorescence du fond d’œil. Les ophtalmologistes qui procèdent au dépistage de la HR ont l’obligation de comprendre ce qui constitue un test positif, quels sont les artefacts potentiels et comment utiliser de multiples modalités pour augmenter la confiance clinique dans un diagnostic. Le sujet a été exploré en profondeur dans de multiples publications.1,12,13 Le fait de ne pas interpréter correctement les tests des patients a constitué la base d’importants règlements pour faute professionnelle dans des cas manqués de HR.
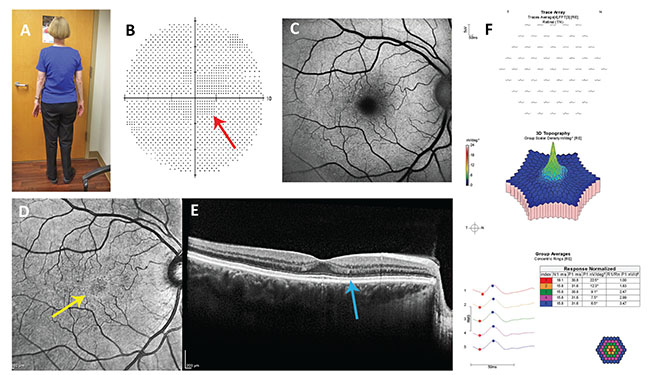
Figure 2. Rapport de cas #2 : A : Notez le somatotype. Chez le patient asthénique, la posologie basée sur le poids corporel réel, et non sur le poids corporel idéal, est appropriée. B : Le scotome central non reproductible (flèche rouge) dans son test de champ visuel 10-2 n’est pas typique d’une rétinopathie due à l’hydroxychloroquine. C : L’autofluorescence du fond bleu est normale. D : L’imagerie par réflectance dans le proche infrarouge montre un anneau hyperréfléchissant (flèche jaune) qui a une faible sensibilité et spécificité pour la rétinopathie due à l’hydroxychloroquine. E : La réflectivité de la ligne ellipsoïde dans la parafovéa est légèrement inférieure à celle de la fovéa, un signe potentiellement précoce de rétinopathie. F : l’électrorétinographie multifocale est normale.
Rapport de cas #2
En 2015, un ophtalmologiste a examiné une femme de 63 ans atteinte de polyarthrite rhumatoïde qui prenait 400 mg/j d’HC depuis 1990 (25 ans, 3 650 g de dose cumulée). Elle mesurait 5 pieds 3 pouces et pesait 112 livres. Elle ne souffrait d’aucune maladie rénale ou hépatique. Son acuité visuelle corrigée était de 20/20 et son examen du fond d’œil était normal des deux côtés. Son champ visuel 10-2 réalisé avec un objet test rouge a montré un scotome central relatif non reproductible (Figure 2). L’autofluorescence du fond d’œil était normale. L’imagerie par réflectance dans le proche infrarouge a montré un léger anneau hyperréfléchissant, qui a été associé de manière incohérente à une HR précoce.14 La SD-OCT a montré une ligne ellipsoïde légèrement moins hyperréfléchissante et une suggestion d’amincissement de la couche nucléaire externe. L’électrorétinographie multifocale était normale.
Comme il n’y avait pas de rétinopathie définie, elle a été autorisée à poursuivre l’utilisation de l’HC, mais son dosage toxique a été corrigé. Le plus petit de son PCA et de son PBI était son PCA, qui était de 112 livres. Par conséquent, la limite supérieure de sa dose quotidienne sûre était de 330 mg. Il a été recommandé qu’elle ne prenne pas plus de 200 mg/j pendant les six prochains mois, date à laquelle des tests auxiliaires répétés ont été recommandés pour déterminer s’il y avait un signal de rétinopathie précoce étant donné sa grande dose cumulative.
Les publications rhumatologiques contribuent également à la confusion sur la posologie. Dans un article publié en avril sur le site Web de rhumatologie RheumNow.com, l’auteur écrit : » Les facteurs de risque connus pour le développement de dépôts oculaires comprennent la durée du traitement, la dose cumulative et la fonction rénale « .15 Elle ne mentionne pas le facteur de risque le plus important, et le seul modifiable, à savoir la posologie quotidienne. Elle poursuit en écrivant : « L’Académie américaine d’ophtalmologie (AAO) conseille une posologie basée sur le poids de 6,5 mg/kg, avec une limite supérieure de 400 mg/jour. Les exceptions sont les personnes de petite taille et les patients obèses, pour lesquels l’AAO conseille de calculer la posologie en fonction du poids corporel idéal pour la taille. » Ce n’est cependant pas ce que dit la référence citée. Au lieu de cela, elle indique : « La recommandation précédente mettait l’accent sur le dosage en fonction du poids. Cependant, la plupart des patients reçoivent systématiquement 400 mg d’HCQ par jour. …Cette dose est maintenant considérée comme acceptable, sauf pour les individus de petite taille, pour lesquels la dose doit être déterminée sur la base du poids corporel idéal afin d’éviter un surdosage. « 16
L’auteur poursuit : « La sensibilité et la spécificité de ces tests ne sont pas encore connues pour la toxicité rétinienne liée à l’hydroxychloroquine. Il existe un taux élevé d’anomalies de base, en particulier chez les personnes âgées ou souffrant d’une maladie comorbide, ce qui rend les changements difficiles à interpréter. Un autre problème est que le lupus érythémateux systémique lui-même s’associe à la présence d’anomalies rétiniennes, ce qui ajoute encore à la complexité du déchiffrage de ces tests. » Ces affirmations sont incorrectes. La sensibilité et la spécificité relatives des tests sont connues (le mfERG est le plus sensible, le 10-2 VF vient ensuite et le SD-OCT est le moins sensible ; le SD-OCT est le plus spécifique, le 10-2 VF vient ensuite et le mfERG est le moins spécifique).17 Le taux d’anomalies de base est élevé pour le test 10-2 VF, mais pas pour le SD-OCT ou le mfERG. Le LED affecte rarement l’un de ces tests.

Enfin, l’auteur préconise une posologie basée sur 6,5 mg/kg/poids corporel réel. Il s’agit d’une recommandation dangereuse pour le patient obèse de petite taille, comme l’illustre le rapport de cas 1.
Dans une revue rhumatologique sur l’HR, les auteurs ont écrit : » Une étude française a montré que la concentration d’HC dans le sang total >1 000 ng/ml réduisait le risque de poussées de lupus. La mesure des taux sanguins d’HC peut suggérer que certains patients ont besoin de >6,5 mg/kg/jour pour atteindre le niveau recommandé. Ces patients ne devraient pas présenter un risque accru de toxicité, à condition que les niveaux soient surveillés, mais il peut être important de surveiller également la dose cumulative lors de l’évaluation du risque de toxicité oculaire. « 18 La déclaration suggère à tort qu’il existe une relation connue entre les niveaux sanguins d’HC et l’HR, mais ce n’est pas le cas.
Si les internistes prescripteurs et les ophtalmologistes de dépistage mettaient en pratique une compréhension plus claire de la posologie quotidienne correcte, la prévalence de l’HR diminuerait. Dans la plupart des cas, cette affection est iatrogène et peut être évitée. La posologie quotidienne est le seul facteur de risque modifiable et mérite la plus grande attention lors des visites de dépistage, surtout au cours des cinq premières années d’utilisation du médicament, avant que la charge cumulative irréversible ne se soit accumulée et n’augmente le risque de rétinopathie. La recommandation selon laquelle les cas à faible risque ne doivent pas faire l’objet d’un dépistage pendant cinq ans après un examen de base a été largement rejetée par ceux qui effectuent le dépistage, et elle est probablement malavisée étant donné la forte prévalence du dosage toxique. La détection et la correction du dosage toxique sont les plus utiles pour la prévention de la rétinopathie au cours des premières années de prise d’HC. Les cas extrêmement rares qui développent une rétinopathie malgré un dosage sûr ont plus de chances d’être détectés lorsqu’un test auxiliaire plus sensible et plus spécifique, par exemple, la FV 10-2 et le SD-OCT, sont utilisés ensemble et lorsque l’interprétation est faite de manière compétente.
Le Dr Browning est un spécialiste de la rétine chez Charlotte Eye, Ear, Nose, and Throat Associates. Contactez le Dr Browning au 6035 Fairview Rd, Charlotte, NC 28210. Vous pouvez le joindre au (704)-295-3180, ou à [email protected].
1. Browning DJ. Hydroxychloroquine et rétinopathie due à la chloroquine. New York : Springer, 2014.
2. McChesney EW, Banks WF Jr, Fabian RJ. Distribution tissulaire de la chloroquine, de l’hydroxychloroquine et de la déséthylchloroquine chez le rat. Toxic App Pharm 1967;10:501-513.
3. Browning DJ, Lee C, Rotberg D. L’impact de différents algorithmes de poids corporel idéal sur le dépistage de la rétinopathie due à l’hydroxychloroquine chez les femmes. Clinical Ophthalmology 2014;8:1401.
4. Browning DJ. Impact des directives révisées de l’Académie américaine d’ophtalmologie concernant le dépistage de l’hydroxychloroquine sur la pratique réelle. Am J Ophthalmol 2013;155:418..
5. Falcone PM, Paolini L, Lou PL. Toxicité de l’hydroxychloroquine malgré un traitement à dose normale. Ann Ophthalmol 1993;25:385-388.
6. Browning DJ. Réponse à Defining Ideal Body Weight. Am J Ophthalmol 2002;134:935-936.
7. Blomquist PH, Chundru RK. Dépistage de la toxicité de l’hydroxychloroquine par les ophtalmologistes du Texas. J Rheumatol 2002;29:1665.
8. Wolfe F, Marmor MF. Taux et prédicteurs de la toxicité rétinienne de l’hydroxychloroquine chez les patients atteints de polyarthrite rhumatoïde et de lupus érythémateux systémique. Arthritis Care Res 2010;62:775-784.
9. Cukras C, Huynh N, vitale S, Wong WT, Ferris III FL, Sieving PA. Tests de dépistage subjectifs et objectifs de la toxicité de l’hydroxychloroquine. Ophthalmology 2015;122:356-366.
10. Lee MG, Kim SJ, Ham DI, Kang SW, Kee C, Lee J, Cha HS, Koh EM. Épaisseur de la couche plexiforme interne des cellules ganglionnaires de la rétine maculaire chez les patients sous traitement à l’hydroxychloroquine. Invest Ophthalmol Vis Sci 2015;56:396-402.
11. FielderA, Graham E, Jones S, et al. Lignes directrices du Royal college of ophthalmologists : Toxicité oculaire et hydroxychloroquine. Eye 1998;12:907-909.
12. Marmor MF, Melles RB. Disparité entre les champs visuels et la tomographie par cohérence optique dans la rétinopathie de l’hydroxychloroquine. Ophthalmology 2014;121:1257-1262.
13. Mititelu M, Wong BJ, Brenner M, et al. Progression des effets toxiques de l’hydroxychloroquine après l’arrêt du traitement médicamenteux. De nouvelles preuves provenant de l’imagerie multimodale. Arch Ophthalmol 2013;131:1187-1197.
14. Wong KL, Pautler SE, Browning DJ. Maculopathie de l’œil de bœuf par réflectance dans le proche infrarouge comme indicateur précoce de la toxicité de l’hydroxychloroquine. Clin Ophthalmol 2015 ; 9:521-5.
15. Petrie M, Durcan L. » Le rôle des taux sanguins d’hydroxychloroquine dans le LED » trouvé sur http://rheumnow.com/blog/role-hydroxychloroquine-blood-levels-sle#.VvaKbIfbwMQ.mailto. Consulté le 28 septembre 2016.
16. Marmor MF, Kellner U, Lai TYY, Lyons JS, Mieler WF. Recommandations révisées sur le dépistage de la rétinopathie due à la chloroquine et à l’hydroxychloroquine. Ophthalmology 2011;118:415.
17. Browning DJ, Lee C. La sensibilité et la spécificité relatives des champs visuels 10-2, de l’électrorétinographie multifocale et de la tomographie par cohérence optique à domaine spectral dans la détection de la rétinopathie due à l’hydroxychloroquine et à la chloroquine. Clinical Ophthalmology 2014;8:1389-1399.
18. Ding HJ, Denniston AK, Rao VK, Gordon C. Hydroxychloroquine-related retinopathy. Rheumatology (Oxford) 2016;55:6:957-67.
0 commentaire